Aber was ist denn nun genau ein Isotop?
 Die uns umgebende Materie besteht aus fast 100 verschiedenen Elementen. Zu welchem dieser Elemente ein Atom gehört, ergibt sich aus der Anzahl der Protonen (positiv geladene Teilchen) und Neutronen (ungeladene Teilchen) im Atomkern. Die Zahl der Protonen bestimmt die Ordnungszahl des Elementes im Periodensystem, die Zahl der Neutronen die Massenzahl.
Die uns umgebende Materie besteht aus fast 100 verschiedenen Elementen. Zu welchem dieser Elemente ein Atom gehört, ergibt sich aus der Anzahl der Protonen (positiv geladene Teilchen) und Neutronen (ungeladene Teilchen) im Atomkern. Die Zahl der Protonen bestimmt die Ordnungszahl des Elementes im Periodensystem, die Zahl der Neutronen die Massenzahl. Wenn zwei Atome gleich viele Protonen haben, also dem gleichen Element zugehören, aber eine unterschiedliche Zahl von Neutronen aufweisen, handelt es sich um Isotope.
Ein Atom des Elements Kohlenstoff hat immer sechs Protonen im Kern (sonst wäre es kein Kohlenstoff), kann aber statt sechs auch sieben oder acht Neutronen enthalten. Dann spricht man von Kohlenstoffisotopen. Ganz einfach ausgedrückt: Zwei Isotope eines Elementes sind wie Zwillinge, von denen einer ein wenig Übergewicht hat. 🙂
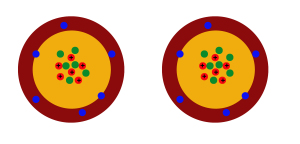
Die Schale des Atoms enthält übrigens immer genau so viele Elektronen wie sich Protonen im Kern befinden (sonst wäre es ein Ion, ein geladenes Teilchen).
Und so werden Isotope gekennzeichnet
Kohlenstoff hat – wie wir eben schon gesehen haben – zwei stabile Isotope, 12C und 13C. In der Natur findet man jedoch fast nur das Isotop mit der Massenzahl 12.Um verschiedene Isotope eines Elementes eindeutig zu kennzeichnen, wird die Massenzahl links oben am Elementsymbol ergänzt, z.B.:
12CO2 : Kohlenstoffdioxid mit sechs Neutronen im Kohlenstoff-Atomkern
13CO2 : Kohlenstoffdioxid mit sieben Neutronen im Kohlenstoff-Atomkern
Stabil und instabil
Fast jedes natürlich vorkommende Element verfügt über mindestens ein stabiles Isotop. Kohlenstoff verfügt über zwei stabile Isotope. Neben diesen beiden stabilen Kohlenstoffisotopen gibt es zudem zwei instabile Isotope: 14C mit einer Halbwertszeit von 5.730 Jahren und 15C mit einer Halbwertszeit von 2,45 Sekunden. 15C kommt allerdings in der Natur nicht vor sondern kann nur künstlich hergestellt werden.Instabile Atomkerne besitzen die Eigenschaft, sich spontan in andere Atomkerne umzuwandeln und dabei ionisierende Strahlung auszusenden. Die Atomkerne zerfallen. Es gibt nur einige wenige Elemente mit ausschliesslich instabilen – also radioaktiven – Atomkernsorten (zum Beispiel Plutonium oder Uran).
Zu chemisch? Zu theoretisch? Schon abgeschaltet?
Dann mal Praxis.
Isotope werden unter anderem eingesetzt, um zwei Atome gleicher Art zu unterscheiden. Beispielsweise tauscht man ein Atom gezielt gegen eins seiner Isotope aus. In der Analyse kann dann das „markierte“ Molekül in Produkten und Stoffen nachgewiesen werden.
Viele diagnostische oder analytische Verfahren sind erst durch den Einsatz verschiedener Isotope möglich. Isotope helfen beispielsweise, den Zeitraum der Entstehung von archäologischen, paläontologischen und geologischen Gegenständen zu bestimmen.
Radiokarbonmethode
Das Verfahren der Radiokohlenstoffdatierung oder Radiokarbonmethode beruht darauf, dass in abgestorbenen Organismen die Menge an gebundenen radioaktiven 14C gemäß Zerfallsgesetz abnimmt. Lebende Organismen sind von diesem Effekt nicht betroffen, da sie ständig neuen Kohlenstoff aus der Umwelt aufnehmen, der den normalen Anteil an 14C-Isotopen nahezu konstant hält. Nach 5.730 Jahren (Halbwertszeit) ist nur noch die Hälfte an 14C vorhanden, während der Anteil an 12C unverändert bleibt. Aus dem Verhältnis von 12C und 14C lässt sich nun das Alter des Fundes bestimmen.
Allerdings darf der Fund nicht älter als 50.000 Jahre alt sein – dann ist die Menge an 14C zu klein, um sie noch verlässlich bestimmen zu können.
Nach 5.730 Jahren (Halbwertszeit) ist nur noch die Hälfte an 14C vorhanden, während der Anteil an 12C unverändert bleibt. Aus dem Verhältnis von 12C und 14C lässt sich nun das Alter des Fundes bestimmen.
Allerdings darf der Fund nicht älter als 50.000 Jahre alt sein – dann ist die Menge an 14C zu klein, um sie noch verlässlich bestimmen zu können.Auf der Suche nach Helicobacter pylori
Der bakterielle Erreger Helicobacter pylori gilt als Indikator für Magenkrebs. Zum Nachweis musste bislang eine Magenspiegelung oder gar ein aufwendiger Eingriff vorgenommen werden. Durch den Einsatz bestimmter Isotopengemische kann die Diagnose nun einfach über den Atem des Patienten erfolgen: Der Erreger wandelt im Harnstoff enthaltenen Kohlenstoff in Kohlendioxid um. Durch den Stoffwechsel wird aus einem 13C-Isotop stabiles 13CO2, das über die Atmung ausgeschieden wird.
Spezielle Gemische aus 12CO2 und 13CO2 dienen als Null- und Referenzgase für das zur Diagnose verwendete massenspektroskopische Verfahren. Auch können Isotope Aussagen zur geografischen Herkunft, zu nicht deklarierten Zusatzstoffen und zur Einhaltung gesetzlicher Bestimmungen von Lebensmitteln geben.
Und…? War doch ganz interessant, oder..? 🙂
Unser Arbeitsgebiet bietet eine Fülle von weiteren spannenden Themen. In diesem Sinne: wir lesen uns. 🙂
Schönen Gruß aus dem Produktmanagement Spezialgase!
Lena Niehues
Header-Bild © lily – Fotolia.com

Ein schöner Beitrag Lena. Als Kristallograph und IT-ler mal ein Beispiel wo in der modernen Computerwelt Isotope auch eine Rolle spielen.
Nur ein Beispiel aus der Hardware. Natürliches Silizium besteht aus 3 Isotopen (92,2 Prozent 28Si, 4,7 Prozent 29Si, 3,1 Prozent 30Si). Silizium wird zur Chip Herstellung verwendet. Sortenreines Silizium (28Si) hat eine um 60% bessere Wärmeleitfähigkeit als die Isotopen-Mischung. Das Ergebnis sind “Coole Chips”.
Liebe Frau Niehues,
sehr schöner Beitrag! Ich wünschte, mein Chemie-Lehrer hätte das Thema früher so anschaulich und verständlich erklären können!
Vielen Dank
Hallo
Kurz und knackig erklärt, Kompliment! Wenn das so mancher Pauker in der Schule auf die Kette bekäme, wäre der Output wesentlich besser. Vor allem hätten wir weniger frustierte oder sogar gescheiterte Schüler.
Mit Laberwissenschaften werden wir die Zukunft jedenfalls nicht meistern. Dazu bedarf es der Technik.
Schöner Artikel! Doch einen Einwand habe ich: Der Vergleich mit dem übergewichtigen Zwilling lädt zu dem Mißverständnis ein, daß es bei Atomen so etwas wie ein Normalgewicht gäbe. Das scheint zwar so zu sein, wenn man Elemente betrachtet, bei denen ein Isotop die natürliche Mischung mit Abstand dominiert. Aber schon bei Kupfer und Zink ist die Situation nicht mehr eindeutig, und bei Zinn, Silber, Quecksilber und Neodym ist man nicht mehr in der Lage, von einem Isotop zu behaupten, daß es sozusagen das “eigentliche” Element repräsentiere.
Sehr gut erklärt. Isotopenanalyse ist nicht nur in der Archäologie sondern auch in der Kriminalistik ein wichtiges Hilfsmittel..